{{cell.content}}




1.神经元之间的信息交流需要“快乐荷尔蒙”
人类的大脑中分布着上百亿个神经元细胞,独立的神经元之间通过“突触”连接。但是一个问题随之而来,信息是如何实现跨越突触传递的?德国药理学家奥托·洛伊维巧妙地设计了蛙心实验证明刺激迷走神经后释放出了某种化学物质,而并非电信号。之后洛伊维成功分离出了该物质,即乙酰胆碱,与戴尔一同获1936年诺贝尔生理或医学奖,这是人类历史上第一个被发现的神经递质。之后瑞典科学家阿尔维德·卡尔森因发现另外一种神经递质多巴胺,并证实其分泌不足会引发帕金森疾病,与另外两位解释突触传递的科学家获得2000年诺贝尔生理或医学奖。从此,神经递质的神秘面纱被逐渐揭开,到目前已发现了包括多巴胺、5-羟色胺、肾上腺素、乙酰胆碱、氨基酸等多种物质可作为神经递质调控神经活动。
2.突触化学传递理论
当动作电位到达某一神经元的终点时,就会驱动储存着有大量神经递质的囊泡向突触前膜融合,将神经递质释放至突触间隙中,将动作电位电信号转化为化学信号并作用于下一个神经元的受体蛋白分子。每个神经元将它与周围成千上万个神经元之间的兴奋性和抑制性信息整合,使得动作电位的“全或无”特性得以表现为不同的生理差异。信息传递机制的发现也催生出大量的毒品,通过吸食毒品来使神经递质过量释放,持续产生兴奋、愉悦的享受感。

图 1. 亨利·哈里特·戴尔爵士(左)与奥托·洛伊维(右)荣获1936年诺贝尔生理学及医学奖。源自诺贝尔奖官网。
3.谁来帮助“快乐荷尔蒙”在大脑运输?
在神经元静息状态下,神经递质一旦被合成就会被运输至囊泡中高浓度储存,直到接收到刺激信号后才会引起囊泡释放,从而防止了持续性刺激。囊泡膜上必然存在某种可以将多种神经递质逆浓度梯度转运到囊泡内的物质。在20世纪70年代,科研人员鉴定出位于脑中的一种转运蛋白负责将神经递质转运并存储起来,并命名为VMAT2。五十年以来, VMAT2的底物偏好性和药理学等性质逐步被揭示。VMAT2属于溶质转运18家族成员SLC18,能够利用囊泡内的质子电化学梯度促进底物转运,据测算每转运一个单胺神经递质需要消耗两个质子。如果把大脑比作城市,物质信息传递则通过一条条“神经元高速公路”进行,囊泡是满载“神经递质货物”的卡车,那么VMAT2则相当于卡车自带的“货物起重机”,通过消耗卡车内的质子作为“能源”,确保城市间信息传递高效且迅速。
如果没有VMAT2,那么卡车将会白跑一趟甚至罢工,最终导致神经递质释放不足,引发一系列单胺缺乏症状和疾病,包括发育迟缓、运动障碍、抑郁症、亨廷顿舞蹈症等疾病。VMAT2的生理意义如此重要,探究VMAT2的结构及其工作机制将对多种精神疾病的药物靶点研发起到推动作用。
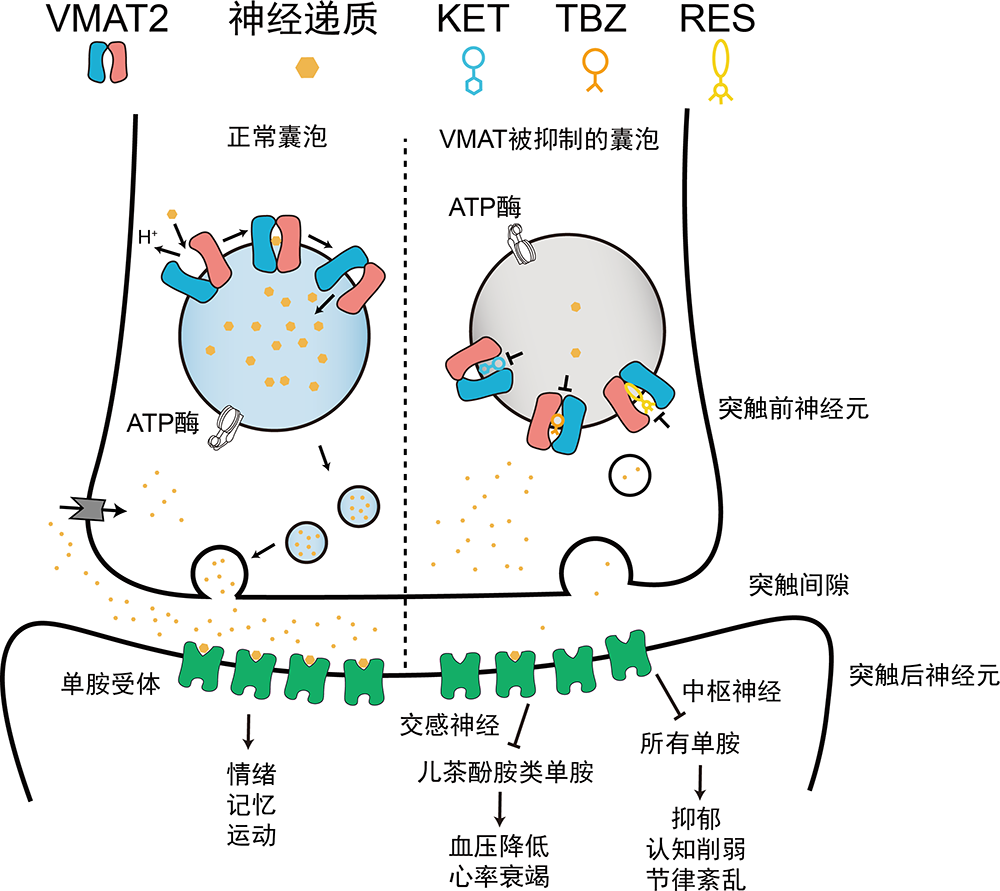
图2. 神经元中VMAT2的作用机制
4.转运蛋白结构新发现
最近,来自中国科学院物理研究所姜道华团队和生物物理研究所赵岩团队利用冷冻电镜单颗粒技术解析了单胺转运蛋白VMAT2多种状态的高分辨结构,详细解释了单胺神经递质的被转运到囊泡中的过程,相关成果已发表于《自然》杂志。
由于VMAT2是一种分子量非常小且缺乏可溶结构域的膜蛋白(分子量仅为56 千道尔顿),利用冷冻电镜单颗粒技术对其进行结构解析非常困难。为了解决这个巨大的难题,研究队伍通过筛选融合蛋白位点,将其他稳定性很好的蛋白质融合在VMAT2的胞外区,成功得到分子量增大、性质稳定、有刚性信号的VMAT2融合蛋白,使结构解析的难度大大降低。最终成功通过冷冻电镜手段计算并重构出VMAT2与三种不同药物分子及底物5-羟色胺结合的近原子分辨率结构。
结构分析表明,获得的电镜结构处于胞质朝向、闭塞状态及囊泡腔朝向的不同构象,代表了VMAT2完整转运循环中的三种典型构象。三种不同的构象也代表不同药物的抑制机制可能存在差异。例如,在得到的结构中,利血平、丁苯那嗪、酮色林三种抑制剂结合的VMAT2结构均处于不同的构象。解析出的结构很好地阐释了三种不同药物分子能够稳定VMAT2的构象并阻断运输的分子机制。而底物5-羟色胺结合VMAT2时,VMAT2则处于囊泡朝向的构象,代表着底物即将被释放。
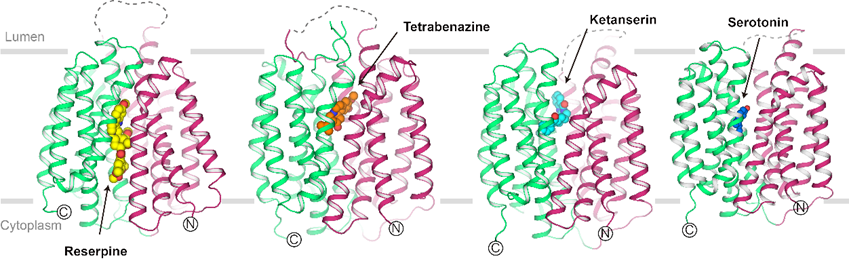
图 3. VMAT2结合不同小分子的结构
结语
总的来说,该研究大大推动了VMAT2转运单胺的研究,为理解VMAT2的底物识别、药物抑制、质子耦合转运过程等分子机制提供了重要的结构基础, 为开发更好的药物分子提供了模板信息。同时,该研究中解析VMAT2的方法能够应用于其他小型膜蛋白,将促进膜转运蛋白和其他小蛋白的电镜结构解析。
尽管已经取得了阶段性进展,但研究团队还想继续深入探究下去。例如,VMAT2可识别多种内源及外源底物,它们的转运机制是共通的吗?转运过程中质子是如何参与并驱动蛋白构象转换的?这些问题仍然等待研究人员解答。
中国科学院物理研究所姜道华特聘研究员和生物物理所赵岩研究员为论文的共同通讯作者。中国科学院物理研究所博士生武迪、生物物理所博士生陈琦浩及于卓亚、北京望石智慧黄博、北京大学现代农业研究院赵珺为论文共同第一作者。
本研究得到中国科学院战略性先导科技专项(B类)、国家自然科学基金创新群体项目和中国科学院物理研究所人才启动经费的资助 。冷冻电镜数据收集得到中国科学院物理研究所SM10组冷冻电镜中心及软物质公共仪器平台、北京大学现代农业研究院生物微观结构研究平台、中国科学院生物物理所蛋白质科学研究平台生物成像中心的技术支持。
编辑:九一
特别声明:本文为人民日报新媒体平台“人民号”作者上传并发布,仅代表作者观点。人民日报提供信息发布平台。

写下你的评论
{{cell.content}}
{{item.content}}
{{item.content}}